Le propos de cet article est de montrer par des exemples cliniques, sur des résultats correspondants à un recul de 19 mois, la particularité de la technique de manipulation des MPM et leur avantage dans la fixité des matériaux de comblement par rapport aux PRF.
Nous montrerons, de façon immédiate ou à distance lors de réentrée, par la microscopie électronique et par des résultats histologiques, l’aspect structurel du mélange PRF/biomatériau ainsi que son devenir osseux (1).
Quels qu’ils soient, les matériaux de comblement présentent en général des avantages physiques, granulométriques qui leur sont propres mais l’inconvénient majeur de ces « grains » est de manquer de cohésion lors de leur mise en place. De façon fréquente, leur tenue sur le site est aléatoire, soumise aux mouvements naturels du patient et liés à la mobilité des tissus mous sus-jacents. Lorsqu’ils sont mis en sur-contour ils ont tendance à s’effondrer, fuir dans les espaces sous-périostés proches du site, s’évader par des brèches muqueuses sinusiennes ou par les berges de la plaie lors de la suture. Leur utilisation sous forme de MPM corrige ces défauts. Ceci rend leur utilisation plus pertinente que le simple mélange PRF/Biomatériau (2) et leur mise en place dans de bonnes conditions de fixité, pour la réussite d’une ROG.
Nous pensons, comme cela s’observe dans la littérature, que devant l’absence totale de publications cliniques objectives ainsi que de preuves scientifiques avérées, conjuguées à la faiblesse méthodologique des rares études fondamentales que de nouvelles études parfaitement structurées sont nécessaires pour pouvoir justifier l’utilisation des PRF seuls en comblement, tant leurs résultats en clinique humaine nous apparaît faible en terme d’augmentation tissulaire (3). Nous pensons que le PRF a suscité beaucoup d’espoirs mais qu’il a aujourd’hui montré ses insuffisances dans les résultats cliniques. En revanche, nous pensons que les résultats cliniques des MPM nous montrent que leur utilisation est aujourd’hui mieux adaptée aux principes de ROG.
Que ce soit en comblement ou en apposition, la mise en place de PRF seul, ou en sur-contour sur de l’os apposé, recréé un volume trop sensible aux mouvements du lambeau du patient. L’accroissement de volume attendu est le plus souvent anéanti par la mimique qui, dans les premiers jours du post-opératoire, efface le relief.
Ceci est dû au fait qu’en l’état, le PRF ne soit pas miscible de façon homogène avec les cristaux de substituts osseux. La charge minérale du PRF n’est pas possible par la technique conventionnelle d’extraction prescrite pour l’obtention de ce coagulum mais elle est possible par le protocole des MPM (4).
Obtention des MPM
Un échantillon de sang du patient est prélevé par centrifugation afin d’obtenir son fractionnement cellulaire.
Les globules blancs et les plaquettes sont isolés dans le surnageant du fait de leur différence de densité moyenne.
Ces fractions plasmatiques individualisées sont récupérées et mélangées à la phase minérale dans des cupules spécifiquement adaptées et selon le protocole MPM (5).
La fraction prélevée est un composant à la fois riche en plaquettes et il contient le fibrinogène nécessaire à la formation de la MPM. Celle-ci est réalisée dans la cupule dite « cupule à MPM », en per-opératoire, par le protocole défini (5).
Résultats
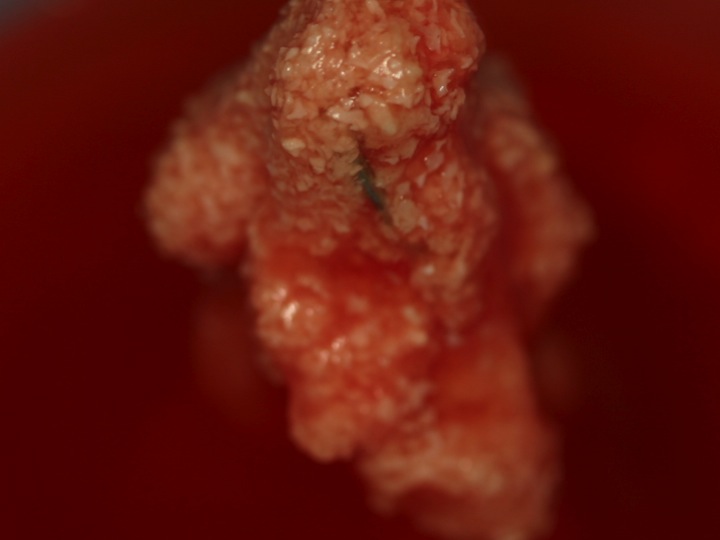
L’aspect macroscopique (Fig. 1) est celui d’un bloc malléable.
En microscopie électronique à balayage, la MPM montre son réseau dense tissé autour des blocs minéraux de façon homogène.
L’aspect microscopique (Fig. 2, Fig. 3, Fig. 4, Fig. 5) est caractéristique par son homogénéité.

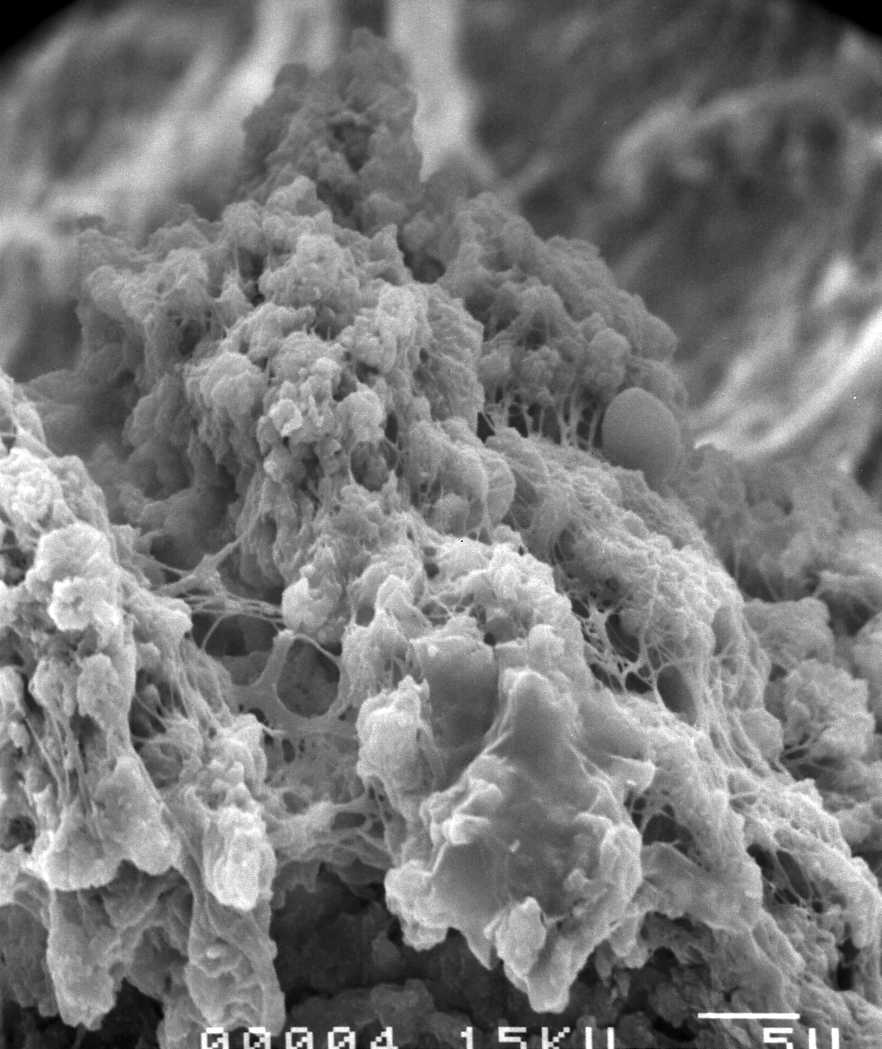
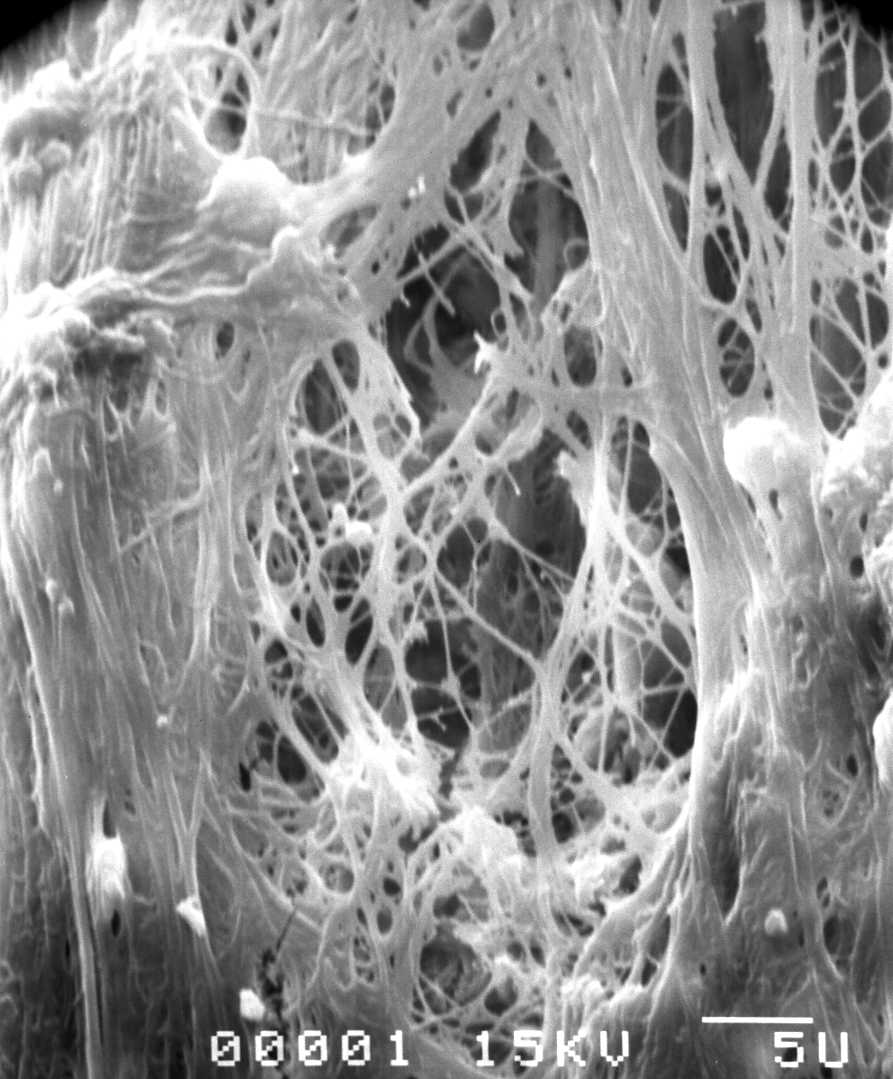

Fig. 2 à Fig.5
Aspect des MPM en microscopie électronique
Analyse histologique des MPM
L’analyse histologique est réalisée à différents temps, avant sa mise en place, à 6 mois et à 19 mois. A ces différents temps les MPM montrent à la fois leur intérêt et leur devenir.

Fig. 6
Matrice Plasmatique Minéralisée au moment de l’insertion osseuse.
L’aspect du maillage (Fig.6) est caractérisé par sa densité et sa liaison intime à la structure minérale. Les éléments cellulaires observés dépendent du volume de surnageant prélevé.
L’intimité de pénétration au sein des cristaux du matériau de comblement est totale et homogène. Cette homogénéité est un facteur favorable à la reconstruction osseuse qui trouve dans tout l’espace à combler une densité de produits de Concentré plaquettaire/Matériau de comblement uniformément répartie. Ainsi, le concentré plaquettaire n’est pas isolé en îlots épars comme nous l’observons dans la technique conventionnelle de mélange.
Sur le plan de la manipulation, la rétention dans une maille fibreuse des fragments d’os ou du matériau de comblement, préserve la cohésion de l’ensemble et évite la fuite du matériau hors du site receveur.
La coupe histologique d’une MPM sortant de la cupule à MPM, montre dans sa phase d’utilisation clinique en dehors de tout contact du site osseux les caractéristiques du composé obtenu. Ces coupes montrent que les composés cellulaires observés dans les deux étapes, vasculaires et cellulaires de l’inflammation, sont déjà représentés dans la masse avant même l’insertion du greffon. Ceci est seulement l’effet de la technique de mélange. En effet, ces phases apparaissent du fait de la prise de sang. Elles sont caractérisées par l’émission, dans la cupule à MPM, d’éléments cellulaires classiquement observés lors de la phase cellulaire de l’inflammation. Ces éléments figurés du sang sont, de ce fait, observés sur la coupe histologique d’une MPM à t=0, avant sa mise en place sur le site receveur.
Sur cette coupe histologique d’une MPM à t=0, avant son insertion nous pouvons observer un réseau d’os synthétique non biréfringent en lumière polarisée qui délimite les logettes. Au contact de l’os existe un matériel éosinophile fibrillaire et pauci-cellulaire. Les cellules sont présentes et représentées essentiellement par des mononucléés, monocytes et lymphocytes. On observe la fibrine organisée en réseau dense entre ces cristaux et pénétrant dans la lumière de leurs vacuités.
A un plus fort grossissement, l’homogénéité de la pénétration de la fibrine s’observe par l’aspect fibrillaire dense sur laquelle des éléments cellulaires sont toujours présents.
A un plus fort grossissement (Fig.7), les éléments cellulaires se distinguent sur l’ensemble des réticulations qui forment des fines stries en forme de réseaux transversaux.

Fig.7
Ces cellules observées sont des monocytes provenant du sang circulant prélevé, ils sont originaires de la moelle osseuse hématopoïétique.

Fig.8
Les monocytes interviennent dans de nombreux métabolismes, leur fonction principale est la phagocytose. La présence de monocytes, à l’intérieur de la structure minéralisée de la MPM à t=0 (Fig.8) , laisse penser que ces cellules, dont la transformation ostéoclastique dans l’os est connue, sont mieux réparties sur le site. Ces cellules comme tous les monocytes sont capables de débuter la phase de réparation cellulaire dès la mise en place du comblement.
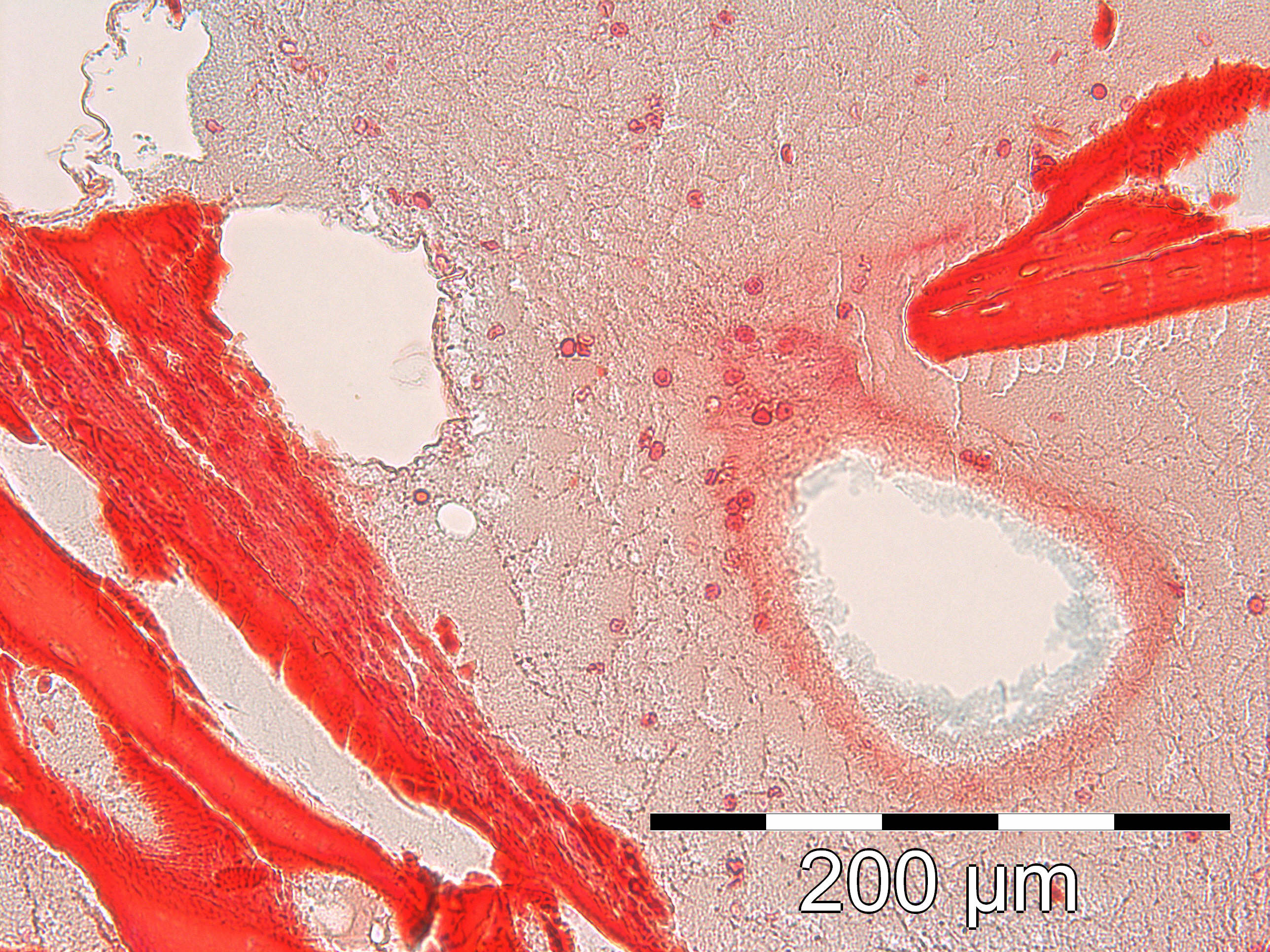
Fig.9
Résultat comparé d’une MPM avec Bio-oss®
Si nous comparons la MPM (Fig.9) avec ce qui est obtenu lors d’un simple mélange de biomatériau et de caillot sanguin (Fig.10), nous observons un encombrement cellulaire par la lignée rouge. Les hématies réalisent un hématome de type post-opératoire, il s’agit sur cette coupe d’un simple caillot entourant le BioOss, cette vue montre l’importance de la phagocytose nécessaire à la détersion du site avant sa recolonisation cellulaire et sa réparation.
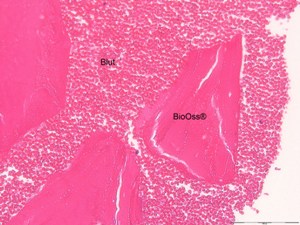
Fig.10
Résultat comparé du simple mélange Bio-oss®+ sang
Etude histologique de la Matrice Plasmatique Minéralisée au 7° mois.
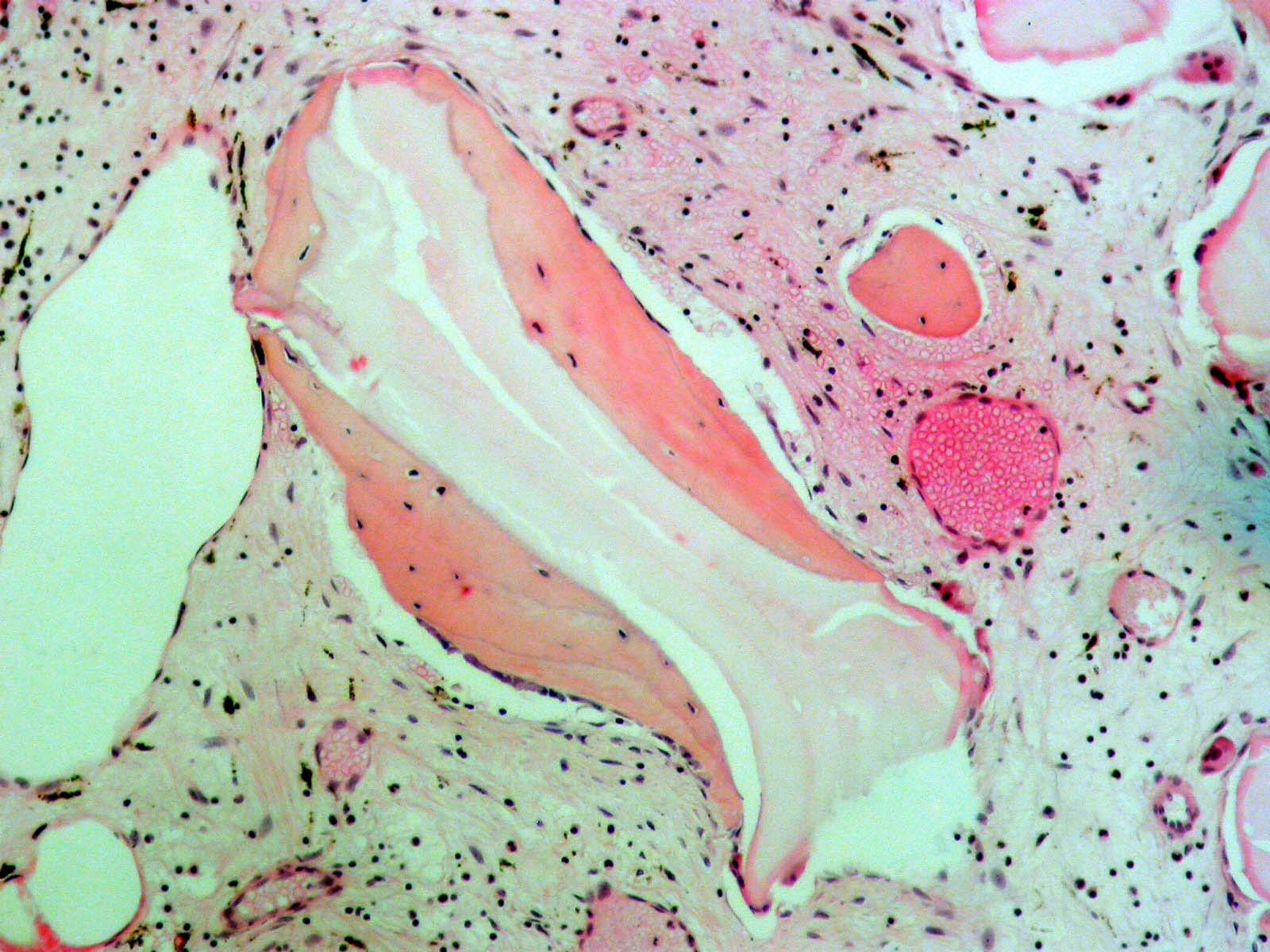
Fig.11
Sur une réentrée du 7° mois, à l’histologie (Fig.11), nous observons un tissu osseux de type spongieux fait de travées anastomotiques. Le centre des travées est occupé par un matériel faiblement éosinophile et amorphe, non biréfringent. Ces massifs sont cernés en périphérie par un os jeune éosinophile renfermant des ostéocytes cerclant les cristaux du Bio-Oss®. Il est caractérisé par une coloration orangée. On observe également des coupes vasculaires.
L’aspect osseux observé est classique, c’est celui d’un os jeune néoformé riche. Il est issu du comblement par la MPM.
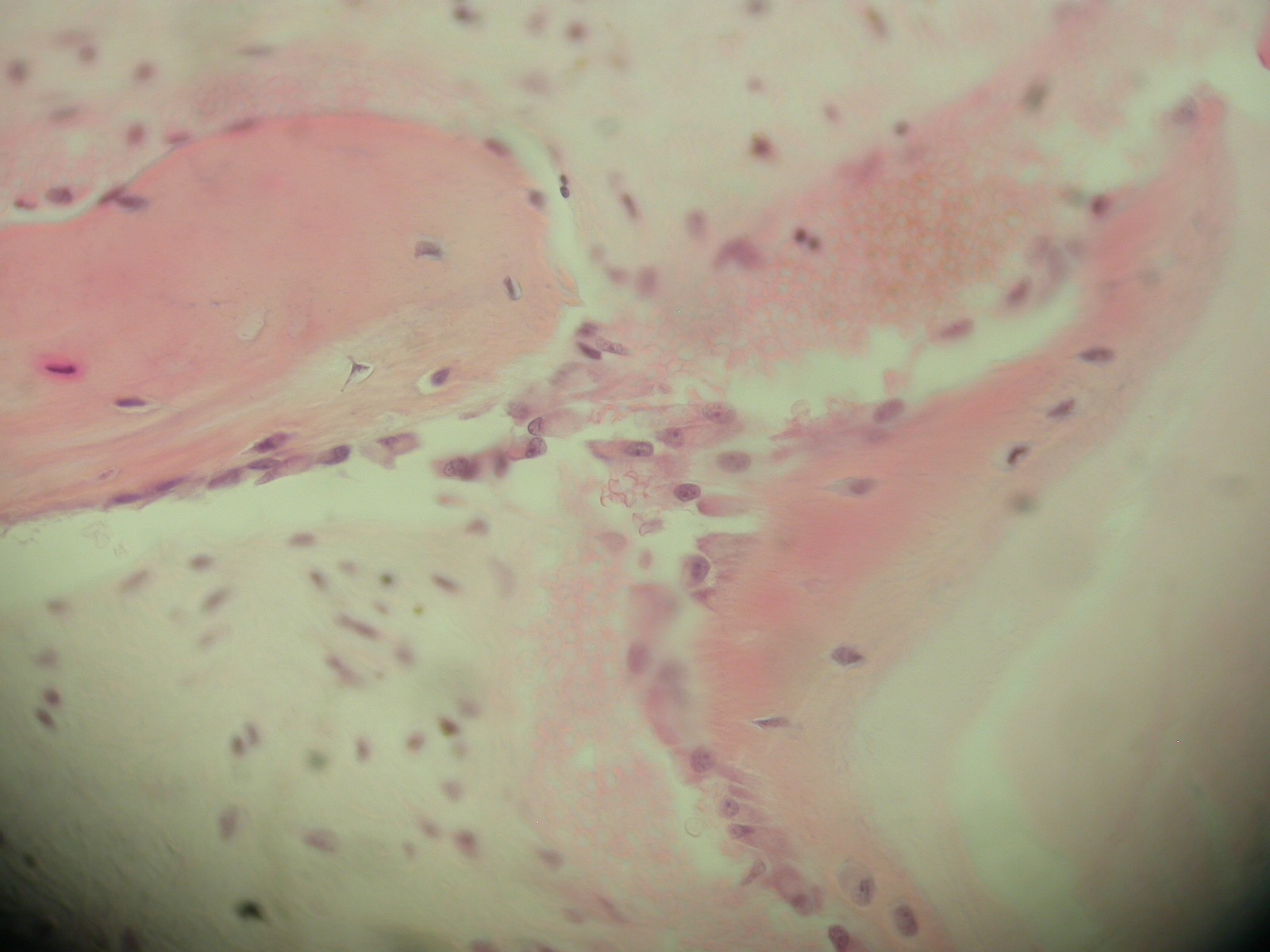
Fig.12
Sur le front de minéralisation s’observent des ostéoclastes (Fig.12) réalisant une frange active de remodelage, témoin d’une croissance tissulaire osseuse au contact des zones amorphes claires et d’un remodelage osseux. Ces éléments montrent qu’un phénomène de conduction osseuse s’est établi. Les coupes font conclure que nous sommes en présence d’une classique néo-ostéogénèse sur une trame d’hydroxyapatite. Nous observons cette même néo-ostéogénèse de la MPM avec tout type de bio-matériaux implantable.
Malgré les potentialités biologiques liées aux éléments cellulaires rencontrés dans les MPM, les temps de consolidation, d’ostéointégration et de remaniement, qui sont liés à des facteurs cellulaires propre aux tissus osseux, ne changent pas. On peut, en revanche, s’attendre à une meilleure adaptation des matériaux aux sites comme nous l’observons cliniquement.
Etude histologique de la Matrice Plasmatique Minéralisée au 19° mois.
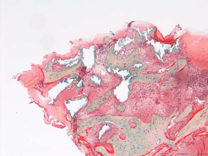
Fig.13
Lors d’une réentrée, au 19 mois, un prélèvement au trépan est effectué sur un site préalablement greffé. Bien que les nécessités du trépan aient causé des destructions partielles du prélèvement, nous pouvons constater, au 19° mois, que les particules minérales de Bio-Oss® sont totalement intégrées dans la continuité du tissus osseux (Fig.13). D’autres particules ont encore un contact avec du tissu conjonctif. Certaines particules ne sont pas intégrées dans la continuité du tissu osseux mais montrent des ilots d’os nouveau à leur surface. Ces ilots sont occupés par de l’ostéoïde. A un plus fort grossissement, des ostéoclastes sont présents ils montrent une activité de remodelage du tissu osseux.
Intérêts cliniques de la Matrice Plasmatique Minéralisée en comblement.
La cohésion du matériau le rend plus apte à s’utiliser dans des situations cliniques critiques dans lesquelles les parois de soutien sont plus aléatoires. En effet on constate qu’il n’est pas nécessaire d’utiliser des membranes armées pour le maintenir au sein du site.
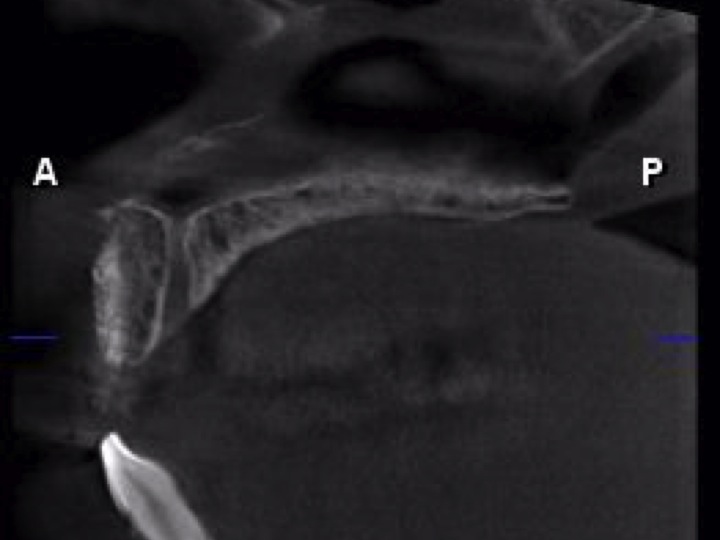
Fig.14
L’utilisation sur crête est possible. Par exemple, sur ce site 11 qui est caractérisé par un seul mur. Une coupe radiologique transversale montre le résultat obtenu (Fig.14).
En apposition sur un site de 45, un recouvrement implantaire est décidé en sur contour (Fig.15, Fig.16)
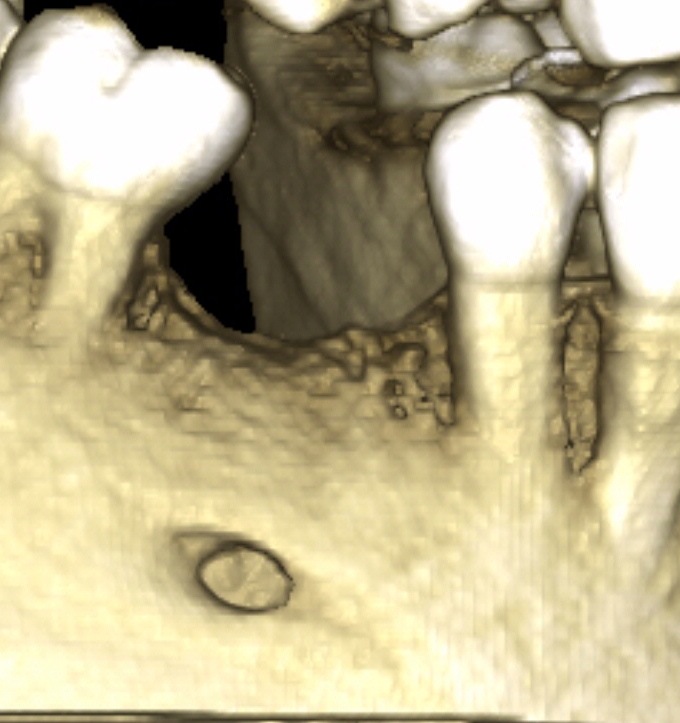
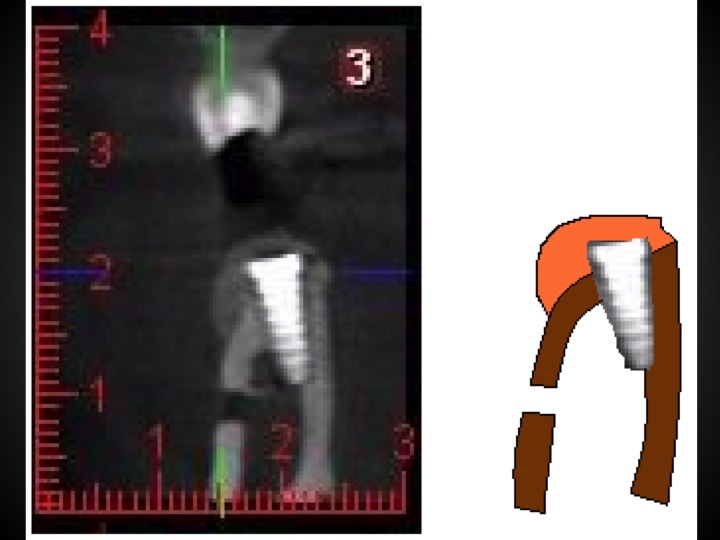
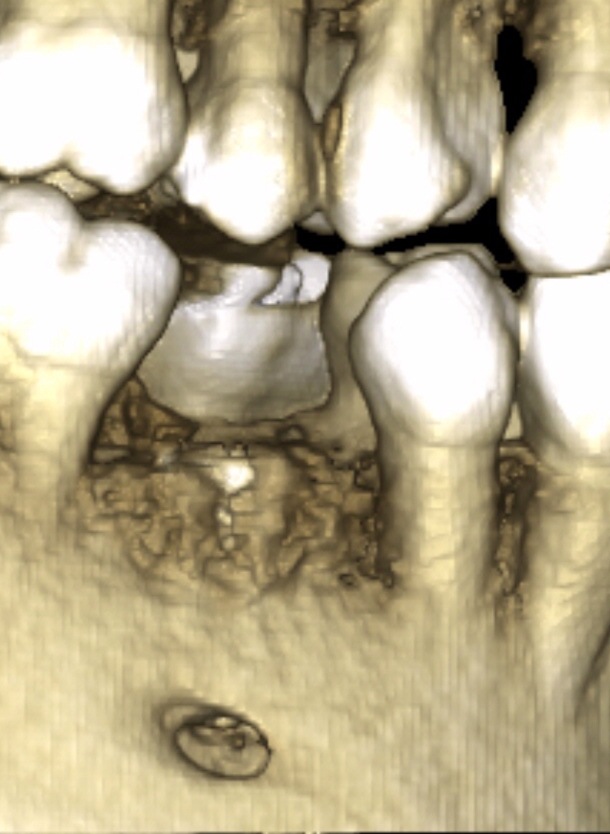
Fig.15, 16, 17
À six mois, nous observons sur le Cone Beam la densification osseuse obtenue en sur-contour sur le site 45 implanté. Un autre cas montre en situation comparative le gain obtenu dans une situation correspondant à un mur sur 45 (Fig.17).
Chez une adolescente présentant une édentation des sites 43 à 46, la mise en place des implants a été réalisée avec apport de MPM (Fig.18).
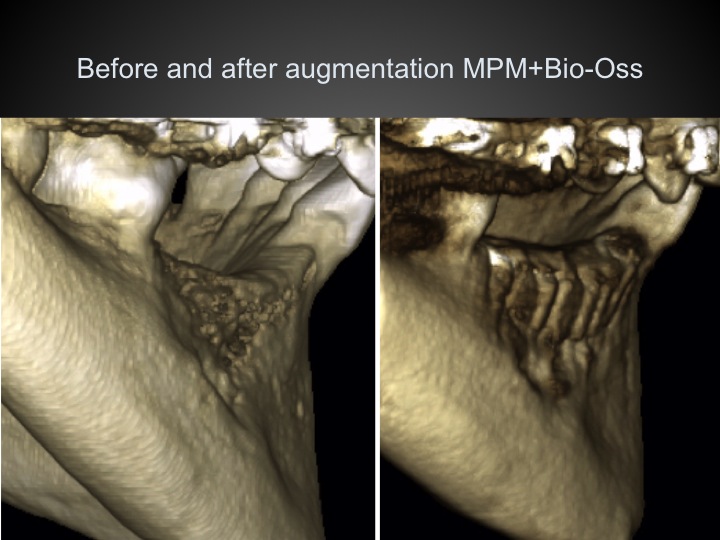
Fig.18
Sur les sites correspondant à une crête résorbée, les comblements en sur-contour sont particulièrement sensibles aux variations de mouvements. Le résultat au 6ème mois montre la stabilité de la reconstruction.
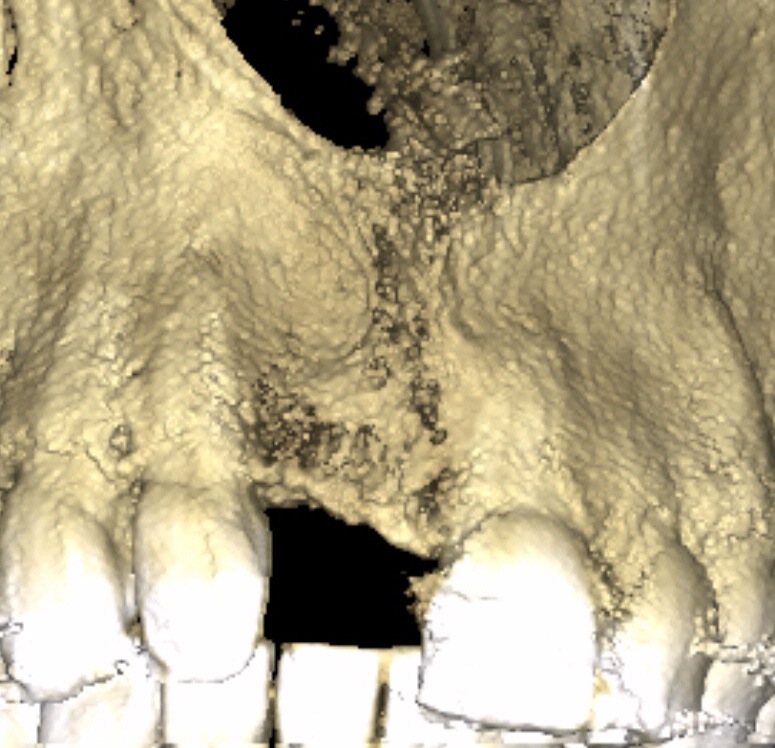
Fig.19
Sur un site de 11 présentant une disparition du pan osseux vestibulaire (Fig.19), l’apposition de MPM a suffit pour redonner un soutien à la muqueuse attachée et un volume implantaire osseux satisfaisant (Fig.20).
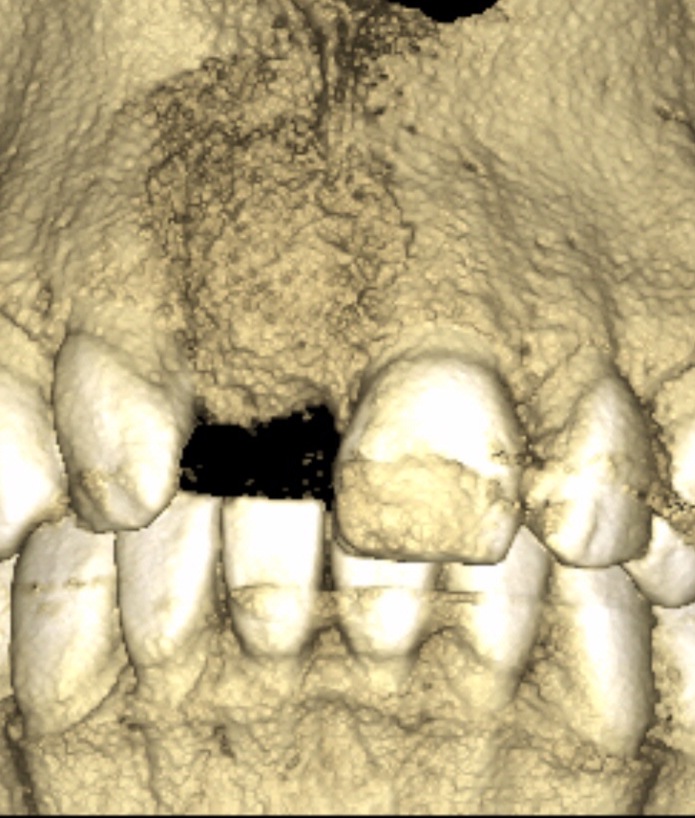
Fig.20
Sur le plan opératoire, ce type de reconstruction par MPM est simple, elle doit être conformée au site par un appui à la compresse.
Sur les sites à deux parois représentés par un défect vestibulo-palatin, la reconstruction par MPM est également possible (Fig.21).
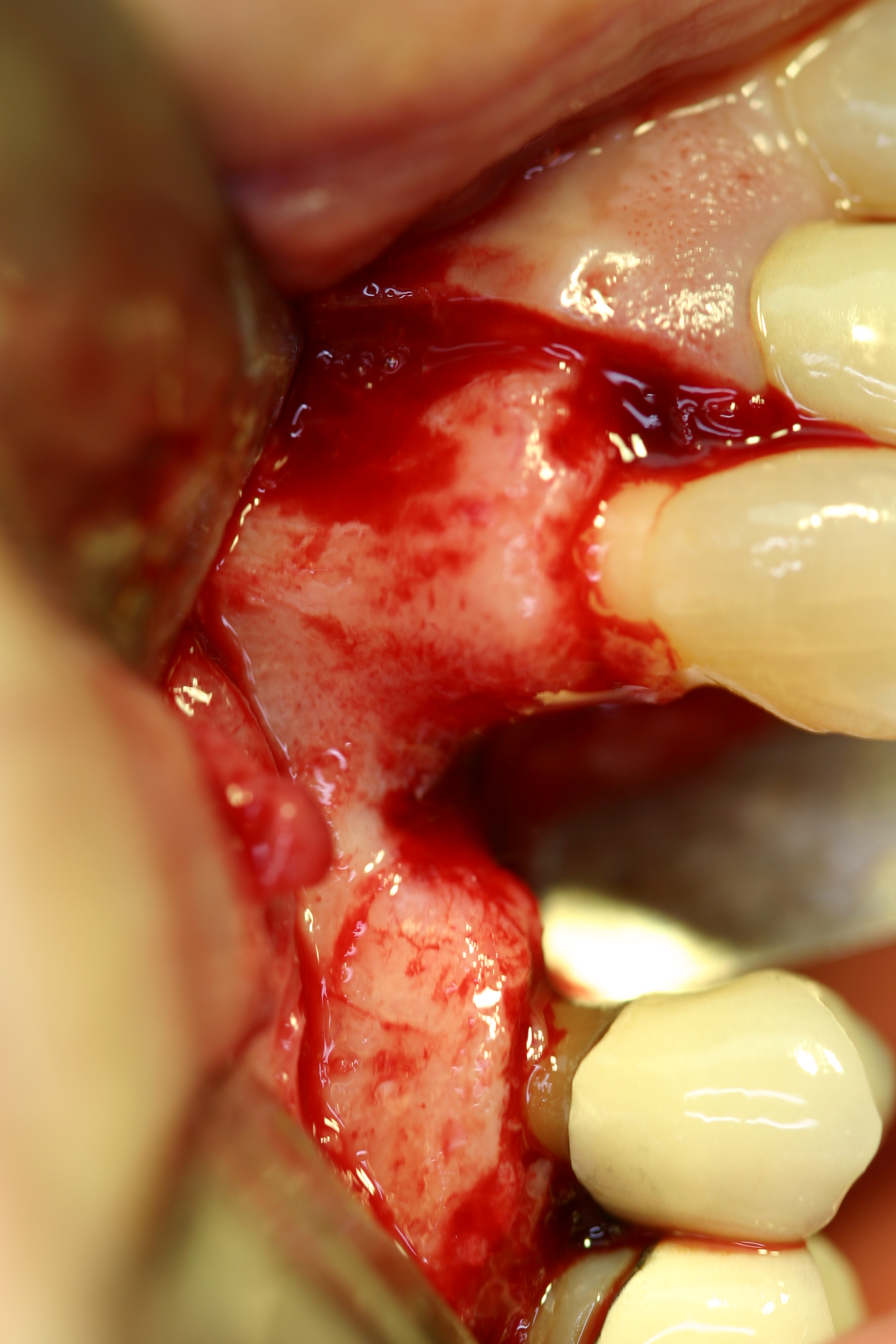
Fig.21
Pour ce type de cas, l’intimité de la conformation au site doit être totale. Un excès du sur-contour est toujours souhaitable, il convient de considérer qu’en sur-contour, comme tout autre élément greffé, la perte osseuse peut se situer de l’ordre du 1/3 de volume. Dans ce cas particulier, la reconstruction est faite par une MPM avec os allogène Biobank® (Fig.22).
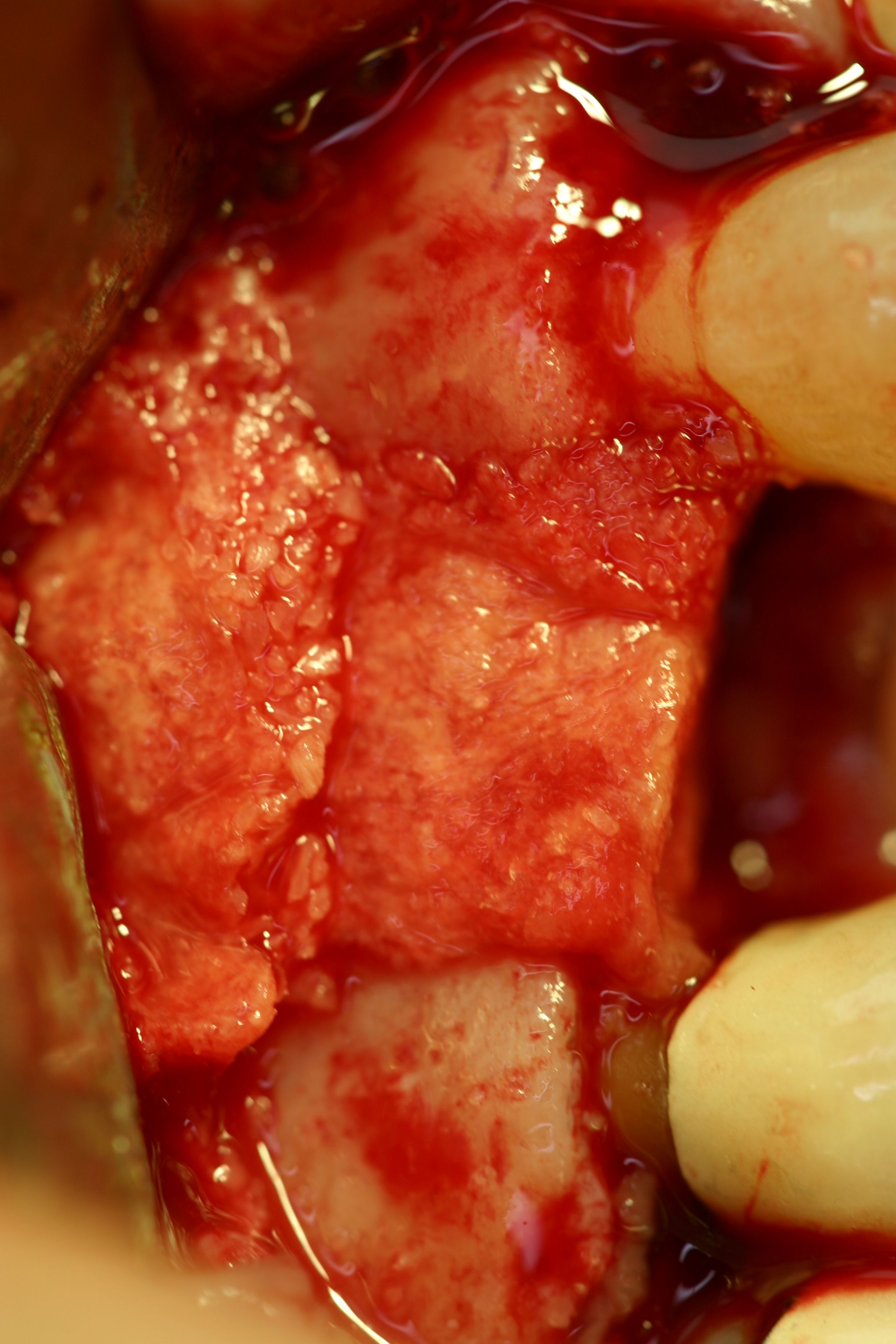
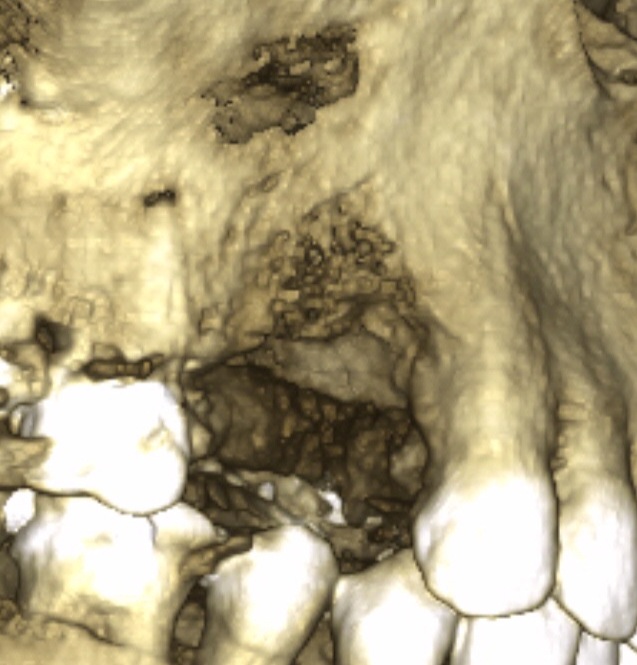
Fig.22, Fig.23
Les sites sinusiens (Fig.23) sont traditionnellement les plus faciles à combler en technique MPM. Celle-ci permet de sécuriser le geste chirurgical. Elle évite la perte éventuelle de matériau de comblement par franchissement d’une muqueuse sinusienne accidentellement perforée tant la cohésion de la MPM est grande.
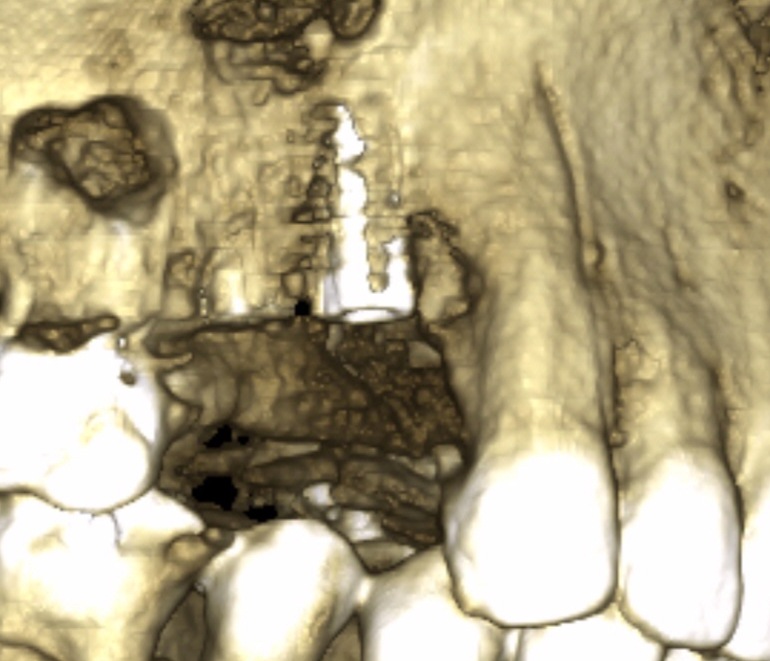
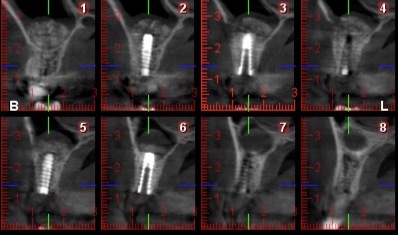
Fig.24, Fig.25
Le scanner de contrôle (Fig.24, Fig.25) montre la précision de logement de la MPM lors d’un abord latéral du sinus. Nous observons une absence de migration des grains. Ce type de reconstruction est efficace et reproductible.
Les cas les plus complexes à traiter sont les cas de sur contour dans lesquels les risques de mobilité des appositions de greffons par granules sont grands. Le site lingual mandibulaire est de ce fait l’illustration typique du cas complexe. Sur le cas présenté, nous pouvons observer sur le Cone Beam de départ un défect lingual secondaire à une perte du pan lingual lors de l’avulsion de la dent (Fig.26, Fig.27)
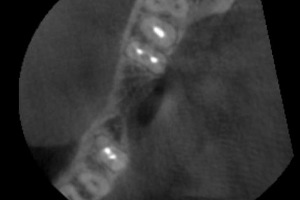
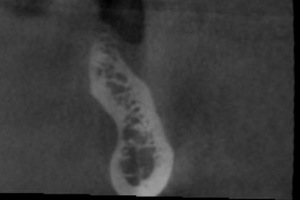
Fig.26 Fig.27
Lors de la réentrée au 6° mois, nous constatons que la crête mandibulaire est régulière et large. Elle présente deux versants : l’un initial, l’autre reconstitué par la MPM avec Osteon® (Fig.28).
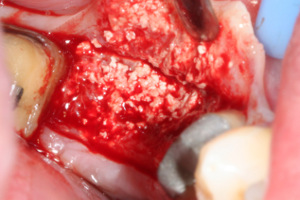
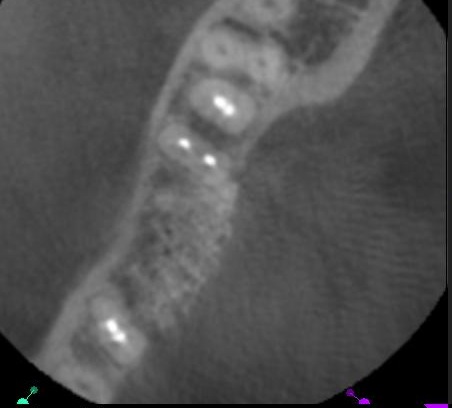
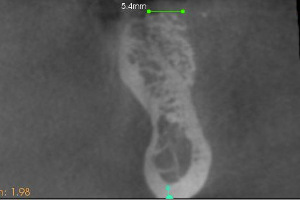
Fig.28, Fig.29, Fig.30
Le Cone Beam de contrôle montre le sur-contour réalisé dans la verticalité de la crête montrant une reconstitution à un pan (Fig.29, Fig.30).
Fig. 31
Le forage osseux sur le site montre la cohésion du résultat de la greffe (Fig.31).
Nous observons, à la fois, le site de la MPM et le site osseux qui sont tous les deux préparés pour recevoir le fut implantaire.
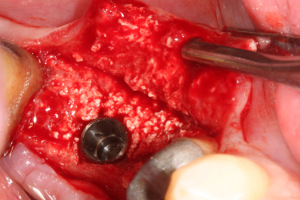
Fig.32
L’implant est placé dans le site. La partie linguale du site est essentiellement le fruit de la MPM avec Osteon® et la partie vestibulaire représente la portion de site originel osseux résiduel post extractionnel (Fig.32).
CONCLUSION
Les techniques de comblement par matériaux de comblement ou par os autogène ont vu une amélioration pratique, biologique et clinique apparaître par leur utilisation sous forme de Matrice Plasmatique Minéralisée. Conditionné selon le protocole MPM le mélange des deux phases Os/Plasma réalise un composé matriciel présentant des avantages de sécurité, de fiabilité, de facilité de manipulation et d’efficacité qui rendent aujourd’hui les greffes de biomatériaux plus prédictibles.
La préparation du matériau de comblement sous forme de MPM est plus favorable à son intégration morphologique au site.
L’aspect biologique des MPM est intéressant puisqu’il inclue en pré-opératoire des facteurs observés lors du temps vasculaire et cellulaire de l’inflammation. Ceci inclue des facteurs biologiques dont le rôle exact est cependant discuté. En effet, malgré la présence de ces facteurs, nous ne constatons pas de raccourcissement des processus cicatriciels dans le temps, ni de changement de nature histologique des résultats cliniques après réentrée au 19ème mois.
Sur le plan clinique, l’utilisation du matériau de comblement sous forme de matrice plasmatique minéralisée (MPM) prend une importance particulière dans tous les sites de greffe implantaires dans la mesure où les MPM favorisent le maintient du biomatériau en bonne forme sur le site. Les MPM améliorent le transport du matériau en sécurisant sa mise en place et en homogénéisant le dosage plasmatique dans un réseau de fibrine dense au niveau de sa masse.
La cohésion du matériau de comblement en préparation sous forme de Matrice Plasmatique Minéralisée le rend plus apte à s’utiliser et à se minéraliser dans des situations cliniques critiques, dans lesquelles les parois de soutien sont plus aléatoires que lors de son utilisation sans MPM.
J. PERISSE, H. BOUZEKRI ALAMI, L. MAZZONI-VASSALAKY, P. CAVERIVIERE, M. BETITO, M. MARCHOU
La Lettre de la Stomatologie N° 53 – Mars 2012
BIBLIOGRAPHIE
(1) Mazzoni L, Périssé J. Apports de la microscopie électronique à Balayage pour la Matrice Plasmatique Minéralisée. La Lettre de la Stomatologie N°51, Septembre 2011
(2) Whitman DH, Berry RL, Green DM. Platelet gel : an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. J Oral Maxillofac Surg 1997 ; 55 ;1294-1299
(3) Ahmad Hamdan, Alain Borghetti, Franck Renouard, Jean-Michel Sautier, Henri Tenenbaum Rapport de la commission scientifique de la SFPIO L’information dentaire 2008
(4) Périssé J. Du PRF et PRP vers les Matrices Plasmatiques Minéralisées (MPM) en implantologie. Implantologie Mai 2011
(5) Boutault-Modiga O, Mazzoni L, Périssé J. Ostéotomie à charnière postérieure et matrice plasmatique minéralisée avec mise en place d’implants. Implantologie Novembre 2011
- Identifiez-vous pour poster des commentaires